प्रतियोगी परीक्षाओं की तैयारी के लिए परमाणु संरचना और पदार्थ की प्रकृति को समझना अत्यंत महत्वपूर्ण है, क्योंकि ये विषय रसायन विज्ञान, भौतिकी और जीव विज्ञान के कई जटिल सिद्धांतों की नींव रखते हैं। रसायन विज्ञान के जनक एंटोनी लेवोजियर द्वारा दी गई परिभाषा से शुरू होकर, यह गाइड आपको तत्वों के वर्गीकरण तक ले जाएगी।
1. पदार्थ की प्रकृति और मूलभूत परिभाषाएँ
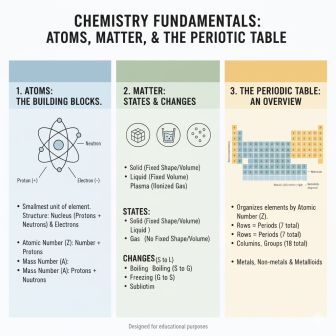
ब्रह्मांड की प्रत्येक वस्तु पदार्थ है, जिसके पास द्रव्यमान होता है और जो आयतन घेरती है। पदार्थ की चौथी अवस्था प्लाज्मा और पाँचवी अवस्था बोस–आइंस्टीन कंडेंसेट भी महत्त्वपूर्ण हैं।
A. शुद्ध पदार्थ – निश्चित संगठन
शुद्ध पदार्थ वे होते हैं जिनका एक निश्चित, अपरिवर्तनीय और स्थिर रासायनिक संगठन होता है।
- तत्व (Element): यह शुद्ध पदार्थ का सबसे सरल रूप है। यह केवल एक ही प्रकार के परमाणुओं से मिलकर बना होता है। उदाहरण: सोना , ऑक्सीजन , कार्बन ।
- यौगिक (Compound): यह दो या दो से अधिक तत्वों के निश्चित भार अनुपात में रासायनिक रूप से संयुक्त होने पर बनता है। यौगिक बनने पर, तत्वों के मूल गुण समाप्त हो जाते हैं। उदाहरण: जल , साधारण नमक ।
- परमाणु (Atom): तत्व का वह सबसे छोटा कण जो रासायनिक अभिक्रिया में भाग लेता है।
- अणु (Molecule): वह सबसे छोटा कण है जो किसी पदार्थ के सभी गुणों को बनाए रखता है और स्वतंत्र रूप से रह सकता है।
B. मिश्रण (Mixtures) – अनिश्चित संगठन
जब दो या दो से अधिक पदार्थ बिना किसी निश्चित अनुपात के केवल भौतिक रूप से मिलाए जाते हैं।
- समांगी मिश्रण (Homogeneous Mixture): इसमें घटक पूरी तरह से घुल जाते हैं और मिश्रण का संगठन हर जगह समान होता। उदाहरण: नमक का घोल, वायु।
- विषमांगी मिश्रण (Heterogeneous Mixture): इसमें घटक अलग-अलग दिखाई देते हैं। उदाहरण: रेत और पानी का मिश्रण।
2. परमाणु की संरचना (Atomic Structure)
परमाणु किसी तत्व की पहचान है और यह तीन मूलभूत उप-परमाण्विक कणों से मिलकर बना होता है।
A. मूलभूत कणों का विस्तृत परिचय
| कण | आवेश | खोजकर्ता | स्थान |
| प्रोटॉन | धनात्मक +1 | अर्नेस्ट रदरफोर्ड | नाभिक (Nucleus) में |
| न्यूट्रॉन | उदासीन 0 | जेम्स चैडविक | नाभिक (Nucleus) में |
| इलेक्ट्रॉन | ऋणात्मक -1 | जे.जे. थॉमसन | नाभिक के चारों ओर कक्षाओं में |
B. नाभिक, संख्याएँ और समस्थानिक
- नाभिक (Nucleus): परमाणु का सघन केंद्र है, जिसे रदरफोर्ड ने खोजा था। परमाणु का लगभग सारा द्रव्यमान इसी में केंद्रित होता है।
- परमाणु संख्या (Atomic Number, Z): नाभिक में प्रोटॉनों की कुल संख्या। यह संख्या तत्व की पहचान निर्धारित करती है।
- समस्थानिक (Isotopes): एक ही तत्व के परमाणु जिनकी समान होती है, लेकिन न्यूट्रॉन की संख्या भिन्न होती है। उदाहरण: हाइड्रोजन के तीन समस्थानिक—प्रोटियम, ड्यूटेरियम, ट्राइटियम।
3. तत्वों का वर्गीकरण: आवर्त सारणी (Periodic Table)
आवर्त सारणी: तत्वों के वर्गीकरण का आधार 🧪
आवर्त सारणी तत्वों को उनके गुणों में समानता के आधार पर व्यवस्थित करने का एक तरीका है। यह हमें एक ही नज़र में तत्वों के रासायनिक और भौतिक गुणों के पैटर्न को समझने में मदद करती है।
1. आधुनिक आवर्त सारणी का आधार
आधुनिक आवर्त सारणी हेनरी मोसले के आधुनिक आवर्त नियम पर आधारित है, जिसके अनुसार:
“तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्या के आवर्ती फलन होते हैं।”
इसका मतलब है कि जब तत्वों को उनकी परमाणु संख्या के बढ़ते क्रम में व्यवस्थित किया जाता है, तो उनके गुणों में एक निश्चित अंतराल के बाद पुनरावृत्ति होती है।
2. आवर्त सारणी की संरचना
आवर्त सारणी क्षैतिज पंक्तियों और ऊर्ध्वाधर स्तंभों से मिलकर बनी है:
A. आवर्त (Periods)
- ये सारणी में सात 7 क्षैतिज पंक्तियाँ हैं।
- महत्व: आवर्त संख्या हमें बताती है कि उस आवर्त के तत्वों के परमाणुओं में कितनी मुख्य ऊर्जा कक्षाएँ हैं। उदाहरण के लिए, आवर्त 3 के सभी तत्वों में 3 कक्षाएँ होती हैं।
| आवर्त संख्या | तत्वों की संख्या | प्रकार |
| 1 | 2 | अति लघु आवर्त |
| 2 और 3 | 8 | लघु आवर्त |
| 4 और 5 | 18 | दीर्घ आवर्त |
| 6 | 32 | अति दीर्घ आवर्त (लैंथेनाइड्स सहित) |
| 7 | 32 | अति दीर्घ आवर्त (एक्टिनाइड्स सहित) |
B. समूह या वर्ग (Groups)
- ये सारणी में अठारह ऊर्ध्वाधर स्तंभ हैं।
- महत्व: एक ही समूह के तत्वों के रासायनिक गुण समान होते हैं, क्योंकि उनके सबसे बाहरी कक्षा संयोजी कोश में इलेक्ट्रॉनों की संख्या समान होती है।
| समूह संख्या | प्रचलित नाम | उदाहरण |
| 1 | क्षार धातुएँ | Li, Na, K |
| 2 | क्षारीय मृदा धातुएँ | Mg, Ca, Ba |
| 17 | हैलोजन | F, Cl, Br |
| 18 | उत्कृष्ट गैसें | He, Ne, Ar |
3. तत्वों का वर्गीकरण: आवर्त सारणी के खंड (Blocks)
इलेक्ट्रॉन भरने के क्रम के आधार पर तत्वों को खंडों s, p, d, f में विभाजित किया गया है:
A. s-ब्लॉक (समूह 1 और 2)
- विशेषता: अंतिम इलेक्ट्रॉन -कक्षक में प्रवेश करता है।
- प्रकृति: ये अत्यधिक क्रियाशील धातुएँ हैं।
- उदाहरण: सोडियम , कैल्शियम ।
B. p-ब्लॉक (समूह 13 से 18)
- विशेषता: अंतिम इलेक्ट्रॉन -कक्षक में प्रवेश करता है।
- प्रकृति: यह खंड सबसे विविध है, जिसमें धातुएँ, अधातुएँ, उपधातुएँ और उत्कृष्ट गैसें शामिल हैं।
- महत्वपूर्ण तत्व: सिलिकॉन और जर्मेनियम उपधातु/अर्धचालक, फ्लोरीन सबसे अधिक विद्युत ऋणात्मक तत्व।
C. d-ब्लॉक (समूह 3 से 12)
- नाम: संक्रमण तत्व।
- विशेषता: अंतिम इलेक्ट्रॉन आंतरिक -कक्षक में प्रवेश करता है।
- गुण: ये परिवर्तनीय ऑक्सीकरण अवस्थाएँ दर्शाते हैं, रंगीन आयन बनाते हैं, और उत्प्रेरक के रूप में उपयोग होते हैं।
- उदाहरण: आयरन , गोल्ड , कॉपर ।
D. f-ब्लॉक (आवर्त सारणी के नीचे)
- नाम: आंतरिक संक्रमण तत्व।
- विशेषता: अंतिम इलेक्ट्रॉन आंतरिक -कक्षक में प्रवेश करता है।
- दो श्रृंखलाएँ:
- लैंथेनाइड्स: दुर्लभ मृदा तत्व।
- एक्टिनाइड्स: इनमें अधिकांश तत्व रेडियोधर्मी होते हैं जैसे यूरेनियम , प्लूटोनियम ।
4. आवर्ती रुझान (Periodic Trends) – गुणों में पैटर्न
आवर्त सारणी में कुछ गुण एक नियमित पैटर्न में बदलते हैं, जिन्हें जानना परीक्षा के लिए आवश्यक है:
A. परमाणु त्रिज्या (Atomic Radius)
- आवर्त में बाएँ से दाएँ:घटती है।
- कारण: नाभिकीय आवेश बढ़ने के कारण।
- समूह में ऊपर से नीचे:बढ़ती है।
- कारण: नई मुख्य कक्षा जुड़ जाने के कारण।
B. आयनन ऊर्जा (Ionization Energy)
- परिभाषा: किसी गैसीय परमाणु से सबसे बाहरी इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा।
- आवर्त में बाएँ से दाएँ: बढ़ती है।
- समूह में ऊपर से नीचे: घटती है।
C. विद्युत ऋणात्मकता (Electronegativity)
- परिभाषा: किसी परमाणु की साझेदारी वाले इलेक्ट्रॉनों को अपनी ओर आकर्षित करने की क्षमता।
- आवर्त में बाएँ से दाएँ: बढ़ती है।
- समूह में ऊपर से नीचे: घटती है।
- महत्वपूर्ण तथ्य: फ्लोरीन आवर्त सारणी में सबसे अधिक विद्युत ऋणात्मक तत्व है।
D. धात्विक प्रकृति (Metallic Character)
- आवर्त में बाएँ से दाएँ: घटती है।
- समूह में ऊपर से नीचे: बढ़ती है।
यह विस्तृत जानकारी आवर्त सारणी के सभी महत्वपूर्ण पहलुओं को कवर करती है। क्या आप किसी विशिष्ट समूह या आवर्ती रुझान के बारे में अधिक गहराई से जानना चाहेंगे?
4. 50 अति महत्वपूर्ण प्रश्नोत्तर (प्रतियोगी परीक्षाओं के लिए) 💡
- रसायन विज्ञान के जनक कौन हैं?
उत्तर: एंटोनी लेवोजियर।
- पदार्थ की चौथी अवस्था क्या है?
उत्तर: प्लाज्मा।
- सबसे हल्का कण कौन-सा है?
उत्तर: इलेक्ट्रॉन।
- परमाणु का लगभग सारा द्रव्यमान कहाँ केंद्रित होता है?
उत्तर: नाभिक में।
- परमाणु की उदासीनता का कारण क्या है?
उत्तर: प्रोटॉन और इलेक्ट्रॉन की संख्या समान होना।
- समस्थानिकों में किसकी संख्या भिन्न होती है?
उत्तर: न्यूट्रॉन की।
- आधुनिक आवर्त सारणी किस पर आधारित है?
उत्तर: परमाणु संख्या पर।
- आवर्त सारणी में क्षैतिज पंक्तियों को क्या कहते हैं?
उत्तर: आवर्त।
- आवर्त सारणी में ऊर्ध्वाधर स्तंभों को क्या कहते हैं?
उत्तर: समूह या वर्ग।
- सबसे अधिक विद्युत ऋणात्मकता वाला तत्व कौन-सा है?
उत्तर: फ्लोरीन F।
- सबसे हल्की ज्ञात धातु कौन-सी है?
उत्तर: लिथियम Li।
- कमरे के तापमान पर कौन-सी धातु द्रव होती है?
उत्तर: पारा Hg।
- कमरे के तापमान पर कौन-सी अधातु द्रव होती है?
उत्तर: ब्रोमीन Br।
- किसे “रसायनों का राजा” कहा जाता है?
उत्तर: सल्फ्यूरिक अम्ल H2SO4।
- सोडियम को किसमें रखा जाता है?
उत्तर: केरोसिन तेल।
- H2O किस प्रकार का पदार्थ है?
उत्तर: यौगिक।
- पीतल किस प्रकार का पदार्थ है?
उत्तर: मिश्रण।
- संयोजी इलेक्ट्रॉन कहाँ पाए जाते हैं?
उत्तर: सबसे बाहरी कक्षा में।
- रदरफोर्ड के प्रयोग ने किसकी खोज की थी?
उत्तर: नाभिक की।
- आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या पर क्या प्रभाव पड़ता है?
उत्तर: घटती है।
- कौन-सा तत्व धातु और अधातु दोनों के गुण प्रदर्शित करता है?
उत्तर: उपधातु।
- उत्कृष्ट गैसें किस समूह में रखी गई हैं?
उत्तर: समूह 18।
- समूह 17 के तत्वों को क्या कहा जाता है?
उत्तर: हैलोजन।
- टंगस्टन किस ब्लॉक का तत्व है?
उत्तर: d-ब्लॉक।
- कौन-सा उपधातु अर्धचालक के रूप में उपयोग होता है?
उत्तर: सिलिकॉन Si।
- जल का घनत्व अधिकतम किस तापमान पर होता है?
उत्तर: 4∘C पर।
- वातावरण में सबसे अधिक मात्रा में कौन-सी गैस पाई जाती है?
उत्तर: नाइट्रोजन N2।
- ओज़ोन परत के क्षरण के लिए मुख्य रूप से कौन-सा यौगिक जिम्मेदार है?
उत्तर: क्लोरोफ्लोरोकार्बन CFCs।
- परमाणु बम किस सिद्धांत पर काम करता है?
उत्तर: नाभिकीय विखंडन।
- सूर्य की ऊर्जा का स्रोत क्या है?
उत्तर: नाभिकीय संलयन।
- कौन-सी अक्रिय गैस वायुमंडल में नहीं पाई जाती है?
उत्तर: रेडॉन Rn।
- बर्फ का गलनांक किस सिद्धांत पर आधारित है?
उत्तर: पदार्थ की अवस्था परिवर्तन।
- कौन-सी अधातु विद्युत की सुचालक है?
उत्तर: ग्रेफाइट।
- अम्ल वर्षा में मुख्यतः कौन-से अम्ल होते हैं?
उत्तर: H2SO4 और HNO3।
- शुद्ध जल का pH मान कितना होता है?
उत्तर: 7।
- LPG का मुख्य घटक क्या है?
उत्तर: ब्यूटेन।
- LPG में गंध के लिए क्या मिलाया जाता है?
उत्तर: इथाइल मरकैप्टन।
- जंग रासायनिक रूप से क्या है?
उत्तर: आयरन ऑक्साइड।
- हीमोग्लोबिन में कौन-सी धातु मौजूद होती है?
उत्तर: आयरन Fe।
- क्लोरोफिल में कौन-सी धातु मौजूद होती है?
उत्तर: मैग्नीशियम Mg।
- चूने के पानी को दुधिया कौन-सी गैस कर देती है?
उत्तर: कार्बन डाइऑक्साइड CO2।
- मार्स गैस किसे कहते हैं?
उत्तर: मीथेन CH4।
- कौन-सी धातु चाकू से काटी जा सकती है?
उत्तर: सोडियम Na।
- धातुओं के ऑक्साइड की प्रकृति कैसी होती है?
उत्तर: क्षारीय।
- सोना किस ब्लॉक का तत्व है?
उत्तर: d-ब्लॉक।
- कौन-सा तत्व आवर्त सारणी का पहला तत्व है?
उत्तर: हाइड्रोजन H।
- कार्बन डेटिंग में किस समस्थानिक का प्रयोग होता है?
उत्तर: कार्बन-14।
- समभारिकों में किसकी संख्या समान होती है?
उत्तर: द्रव्यमान संख्या।
- इलेक्ट्रॉन बंधुता में कौन-सा तत्व F से अधिक है?
उत्तर: क्लोरीन Cl।
- सबसे भारी ज्ञात तत्व कौन-सा है?
उत्तर: ओस्मियम Os।
एक बार इन टॉपिक को भी देखें