आपके लिए अम्ल, क्षार और लवण पर एक विस्तृत, प्रतियोगी परीक्षा-केंद्रित पोस्ट तैयार है, जिसमें pH मान, महत्वपूर्ण लवण और उनके दैनिक जीवन में उपयोग को समझाया गया है, साथ ही 50 महत्वपूर्ण प्रश्नोत्तर भी शामिल किए गए हैं।
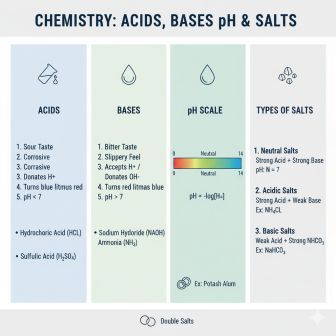
अम्ल Acids, क्षार Bases और लवण Salts रसायन विज्ञान की नींव हैं। प्रतियोगी परीक्षाओं के लिए इनकी परिभाषा, pH स्केल और दैनिक जीवन में उनके अनुप्रयोगों को समझना अत्यंत आवश्यक है।
1. अम्ल Acids
अम्ल वे रासायनिक पदार्थ हैं जिनका स्वाद खट्टा होता है और जो नीले लिटमस पत्र को लाल कर देते हैं।
A. अम्ल की परिभाषा
| सिद्धांत | परिभाषा | उदाहरण |
| आरहेनियस Arrhenius | वे पदार्थ जो जलीय विलयन में H+ आयन हाइड्रोजन या हाइड्रोनियम आयन H3O+ देते हैं। | सल्फ्यूरिक अम्ल H2SO4, हाइड्रोक्लोरिक अम्ल HCl |
| ब्रोंस्टेड–लॉरी Bronsted-Lowry | वे पदार्थ जो प्रोटॉन H+ का त्याग करते हैं प्रोटॉन डोनर। | HCl, H2O |
| लेविस Lewis | वे पदार्थ जो इलेक्ट्रॉन युग्म को ग्रहण करते हैं इलेक्ट्रॉन पेयर एक्सेप्टर। | बोरॉन ट्राईफ्लोराइड BF3 |
B. अम्लों का वर्गीकरण
- प्रबल अम्ल Strong Acids: ये जलीय विलयन में लगभग पूरी तरह से आयनित हो जाते हैं H+ की उच्च सांद्रता। उदाहरण: HCl,HNO3,H2SO4।
- दुर्बल अम्ल Weak Acids: ये आंशिक रूप से आयनित होते हैं H+ की कम सांद्रता। उदाहरण: एसिटिक अम्ल CH3COOH, कार्बनिक अम्ल H2CO3।
- सांद्र और तनु अम्ल: सांद्र अम्ल में जल की मात्रा कम जबकि तनु अम्ल में जल की मात्रा अधिक होती है।
2. क्षार Bases
क्षार वे पदार्थ हैं जिनका स्वाद कड़वा होता है और जो लाल लिटमस पत्र को नीला कर देते हैं। जल में घुलनशील क्षारों को क्षारक Alkali कहा जाता है।
A. क्षार की परिभाषा
| सिद्धांत | परिभाषा | उदाहरण |
| आरहेनियस | वे पदार्थ जो जलीय विलयन में हाइड्रॉक्साइड OH− आयन देते हैं। | सोडियम हाइड्रॉक्साइड NaOH, पोटैशियम हाइड्रॉक्साइड KOH |
| ब्रोंस्टेड–लॉरी | वे पदार्थ जो प्रोटॉन H+ को ग्रहण करते हैं प्रोटॉन एक्सेप्टर। | NH3, OH− |
| लेविस | वे पदार्थ जो इलेक्ट्रॉन युग्म का त्याग करते हैं इलेक्ट्रॉन पेयर डोनर। | अमोनिया NH3 |
B. क्षारों का वर्गीकरण
- प्रबल क्षार Strong Bases: ये जलीय विलयन में पूरी तरह से आयनित हो जाते हैं OH− की उच्च सांद्रता। उदाहरण: NaOH,KOH।
- दुर्बल क्षार Weak Bases: ये आंशिक रूप से आयनित होते हैं OH− की कम सांद्रता। उदाहरण: अमोनियम हाइड्रॉक्साइड NH4OH, Mg(OH)2।
3. pH स्केल और उदासीनीकरण
A. pH मान Power of Hydrogen
pH स्केल का उपयोग किसी विलयन में H+ आयनों की सांद्रता मापने के लिए किया जाता है, जो उसकी अम्लता या क्षारकता को दर्शाता है।
- pH का सूत्र: pH=−log[H+]
- pH मान: 0 से 14 तक।
| pH रेंज | प्रकृति | H+ आयन |
| 0 से 7 से कम | अम्लीय Acidic | H+>OH− |
| 7 | उदासीन Neutral | H+=OH− |
| 7 से 14 | क्षारीय Basic | H+<OH− |
B. उदासीनीकरण अभिक्रिया Neutralization Reaction
यह वह अभिक्रिया है जिसमें एक अम्ल और एक क्षार आपस में क्रिया करके लवण और जल बनाते हैं।
अम्ल+क्षार→लवण+जल
उदाहरण: HCl+NaOH→NaCl+H2O
4. लवण Salts
लवण उन आयनिक यौगिकों को कहते हैं जो उदासीनीकरण अभिक्रिया के परिणामस्वरूप बनते हैं। इनमें धातु या अमोनियम आयन से प्राप्त धनावेशित आयन Cation और अधातु से प्राप्त ऋणावेशित आयन Anion होते हैं।
A. pH के आधार पर लवणों के प्रकार
लवण 7 pH पर उदासीन हो सकते हैं या अम्लीय/क्षारीय हो सकते हैं, जो इस बात पर निर्भर करता है कि वे किस अम्ल और क्षार से बने हैं:
- उदासीन लवण Neutral Salt: pH=7 प्रबल अम्ल + प्रबल क्षार। उदाहरण: सोडियम क्लोराइड NaCl।
- अम्लीय लवण Acidic Salt: pH<7 प्रबल अम्ल + दुर्बल क्षार। उदाहरण: अमोनियम क्लोराइड NH4Cl।
- क्षारीय लवण Basic Salt: pH>7 दुर्बल अम्ल + प्रबल क्षार। उदाहरण: सोडियम कार्बोनेट Na2CO3।
5. महत्वपूर्ण लवण और उनके उपयोग
| लवण Chemical Name | रासायनिक सूत्र Formula | सामान्य नाम Common Name | प्रमुख उपयोग Uses |
| सोडियम क्लोराइड NaCl | NaCl | साधारण नमक Common Salt | भोजन, संरक्षक Preservative |
| सोडियम बाइकार्बोनेट NaHCO3 | NaHCO3 | बेकिंग सोडा Baking Soda | एंटासिड, अग्निशामक यंत्र, बेकरी उत्पाद |
| सोडियम कार्बोनेट Na2CO3⋅10H2O | Na2CO3 | धावन सोडा Washing Soda | काँच और साबुन उद्योग, जल की कठोरता दूर करना |
| कैल्शियम ऑक्सीक्लोराइड CaOCl2 | CaOCl2 | विरंजक चूर्ण Bleaching Powder | जीवाणुनाशक, पेयजल का शुद्धिकरण |
| कैल्शियम सल्फेट हेमीहाइड्रेट CaSO4⋅1/2H2O | CaSO4⋅1/2H2O | प्लास्टर ऑफ पेरिस POP | टूटी हड्डियों को सही जगह स्थिर करना, मूर्तियाँ बनाना |
6. दैनिक जीवन में pH का महत्व
- पाचन तंत्र: हमारा पेट HCl प्रबल अम्ल उत्पन्न करता है जो भोजन को पचाने में मदद करता है। अपच की स्थिति में, एंटासिड जैसे Mg(OH)2 क्षार अम्लता को उदासीन करता है।
- दंत क्षय Tooth Decay: जब मुँह का pH 5.5 से कम हो जाता है, तो दाँतों के इनेमल Enamel का क्षरण शुरू हो जाता है। टूथपेस्ट में मौजूद क्षार इस अम्लता को उदासीन करते हैं।
- पौधों और जानवरों की pH संवेदनशीलता: पौधों को एक विशिष्ट pH रेंज वाली मिट्टी की आवश्यकता होती है। डंक मारने वाले जीव जैसे मधुमक्खी अम्ल मेथेनोइक अम्ल छोड़ते हैं, जिसे बेकिंग सोडा क्षार लगाकर शांत किया जाता है।
- मृदा Soil का pH: यदि मिट्टी अधिक अम्लीय है, तो उसमें बुझा हुआ चूना क्षार मिलाया जाता है, और यदि अधिक क्षारीय है, तो उसमें जैविक पदार्थ जो अम्ल बनाते हैं मिलाए जाते हैं।
अम्ल, क्षार, pH मान, और लवण प्रकार: 50 महत्वपूर्ण प्रश्नोत्तर
1. आरहेनियस सिद्धांत के अनुसार, अम्ल (Acid) जलीय विलयन में कौन सा आयन प्रदान करता है? उत्तर: H+ (हाइड्रोजन आयन)
2. ब्रोंस्टेड–लोरी सिद्धांत के अनुसार, एक क्षार (Base) क्या है? उत्तर: प्रोटॉन (H+) स्वीकर्ता
3. लुईस अम्ल (Lewis Acid) की सबसे उपयुक्त परिभाषा क्या है? उत्तर: इलेक्ट्रॉन युग्म स्वीकर्ता
4. H2O अम्ल और क्षार दोनों के रूप में कार्य कर सकता है। ऐसे पदार्थों को क्या कहते हैं? उत्तर: उभयधर्मी (Amphoteric)
5. एक दुर्बल अम्ल का संयुग्मी क्षार (Conjugate Base) कैसा होता है? उत्तर: प्रबल क्षार
6. pH स्केल पर pH=7 क्या दर्शाता है? उत्तर: उदासीनता
7. यदि किसी विलयन का pH मान 12 है, तो वह विलयन कैसा होगा? उत्तर: प्रबल क्षारकीय (Strongly Basic)
8. pH का सूत्र pH=−log[H+] में ‘p’ का अर्थ क्या है? उत्तर: पोटेंज़ (Potenz) या शक्ति (Power)
9. यदि किसी विलयन में H+ आयन की सांद्रता 10−5 मोल/लीटर है, तो उसका pH मान क्या होगा? उत्तर: 5
10. मानव रक्त का औसत pH मान कितना होता है, जिसे बफर विलयन द्वारा बनाए रखा जाता है? उत्तर: लगभग 7.4
11. एक विलयन का pH मान 8 से बढ़कर 9 हो जाता है। OH− आयन की सांद्रता में क्या परिवर्तन आया? उत्तर: OH− सांद्रता दस गुना बढ़ी
12. सबसे प्रबल अम्ल का pH मान कितना होगा? उत्तर: 1 के करीब या 1 से कम
13. वर्षा के जल का pH मान 5.6 से कम होने पर उसे क्या कहा जाता है? उत्तर: अम्लीय वर्षा
14. शुद्ध जल में H+ और OH− आयनों की सांद्रता क्या होती है? उत्तर: समान (10−7 मोल/लीटर)
15. टूथपेस्ट (Toothpaste) की प्रकृति सामान्यतः कैसी होती है? उत्तर: क्षारकीय (Basic)
16. सिरका (Vinegar) में कौन सा अम्ल पाया जाता है? उत्तर: एसिटिक अम्ल (CH3COOH)
17. पेट की अम्लीयता (Acidity) को दूर करने के लिए किसका उपयोग किया जाता है? उत्तर: एंटासिड (Antacid)
18. संतरा और नींबू जैसे खट्टे फलों में कौन सा अम्ल मौजूद होता है? उत्तर: सिट्रिक अम्ल
19. चींटी के डंक में कौन सा अम्ल होता है? उत्तर: फॉर्मिक अम्ल (मेथनोइक अम्ल)
20. कॉस्टिक सोडा का रासायनिक नाम क्या है? उत्तर: सोडियम हाइड्रॉक्साइड (NaOH)
21. बुझा हुआ चूना (Slaked Lime) का रासायनिक सूत्र क्या है? उत्तर: Ca(OH)2
22. HCl और HNO3 के 3:1 आयतन अनुपात में मिश्रण को क्या कहते हैं? उत्तर: एक्वा रेजिया (Aqua Regia)
23. मैग्नीशिया का दूध (Milk of Magnesia) का रासायनिक सूत्र क्या है, जो एंटासिड के रूप में उपयोग होता है? उत्तर: Mg(OH)2
24. धातुओं के ऑक्साइड सामान्यतः प्रकृति में कैसे होते हैं? उत्तर: क्षारकीय
25. किसे ‘रसायनों का राजा’ (King of Chemicals) कहा जाता है? उत्तर: सल्फ्यूरिक अम्ल (H2SO4)
26. उदासीनीकरण अभिक्रिया (Neutralisation Reaction) में उत्पाद क्या होते हैं? उत्तर: लवण और जल
27. लिटमस पेपर को क्षारकीय विलयन में डालने पर उसका रंग कैसा हो जाता है? उत्तर: लाल से नीला
28. फिनोलफथेलिन (Phenolphthalein) अम्लीय विलयन में कैसा रंग दिखाता है? उत्तर: रंगहीन
29. मेथिल ऑरेंज (Methyl Orange) क्षारकीय विलयन में कैसा रंग देता है? उत्तर: पीला
30. किस प्राकृतिक सूचक का उपयोग अम्लीय विलयन को लाल रंग में बदलने के लिए किया जाता है? उत्तर: लिटमस
31. अमोनियम क्लोराइड (NH4Cl) किस प्रकार का लवण है? उत्तर: अम्लीय लवण (प्रबल अम्ल + दुर्बल क्षार से बना)
32. सोडियम एसीटेट (CH3COONa) के जलीय विलयन का pH मान क्या होगा? उत्तर: pH>7 (क्षारकीय)
33. खाने का सोडा (Baking Soda – NaHCO3) किस प्रकार का लवण है? उत्तर: क्षारकीय लवण
34. विरंजक चूर्ण (Bleaching Powder) का रासायनिक सूत्र क्या है? उत्तर: CaOCl2
35. पोटाश फिटकरी किस प्रकार के लवण का उदाहरण है? उत्तर: द्विक लवण (Double Salt)
36. जल की स्थायी कठोरता (Permanent Hardness) को दूर करने के लिए किस लवण का उपयोग किया जाता है? उत्तर: धावन सोडा (Na2CO3)
37. प्लास्टर ऑफ पेरिस किसके निर्जलीकरण (Dehydration) से प्राप्त होता है? उत्तर: जिप्सम (CaSO4⋅2H2O)
38. एक दुर्बल अम्ल और एक दुर्बल क्षार से बने लवण के विलयन का pH मान किस पर निर्भर करेगा? उत्तर: अम्ल और क्षार की सापेक्ष शक्ति पर
39. बेकिंग सोडा (NaHCO3) का उपयोग आग बुझाने वाले यंत्रों में क्यों किया जाता है? उत्तर: यह आग को बुझाने वाली CO2 गैस छोड़ता है
40. धावन सोडा (Washing Soda) के अणु में क्रिस्टलन जल के कितने अणु होते हैं? उत्तर: 10 (Na2CO3⋅10H2O)
41. किस धातु के बर्तन में दही या अन्य खट्टे पदार्थ नहीं रखने चाहिए? उत्तर: तांबा (Copper) और पीतल (Brass)
42. H3PO4 (फॉस्फोरिक अम्ल) कैसा अम्ल है? उत्तर: ट्राइबेसिक (Tribasic – 3 H+ आयन दे सकता है)
43. वह लवण जिसमें एक से अधिक प्रकार के धनायन या ऋणायन होते हैं, क्या कहलाता है? उत्तर: मिश्रित लवण (Mixed Salt)
44. अम्ल धातुओं से अभिक्रिया करके कौन सी गैस उत्पन्न करते हैं? उत्तर: हाइड्रोजन (H2)
45. टमाटर में मुख्य रूप से कौन सा अम्ल पाया जाता है? उत्तर: ऑक्सालिक अम्ल
46. यदि एक लवण का विलयन लाल लिटमस को नीला कर देता है, तो लवण किससे बना होगा? उत्तर: दुर्बल अम्ल + प्रबल क्षार
47. चूने का पानी (Lime Water) का रासायनिक नाम क्या है? उत्तर: कैल्शियम हाइड्रॉक्साइड (Ca(OH)2)
48. एक अम्ल की क्षारकता (Basicity) क्या होती है? उत्तर: विस्थापित होने वाले H+ आयनों की संख्या
49. वह लवण जिसका कोई भी आयन जलीय विलयन में जल–अपघटन (Hydrolysis) नहीं करता, किस प्रकार का लवण होता है? उत्तर: उदासीन लवण
50. अधातुओं के ऑक्साइड सामान्यतः प्रकृति में कैसे होते हैं? उत्तर: अम्लीय
नोट:
- अम्लीय लवण (NH4Cl) का pH<7 होता है।
- क्षारकीय लवण (Na2CO3, NaHCO3) का pH>7 होता है।
- उदासीन लवण (NaCl) का pH=7 होता है।
एक बार इन टॉपिक को भी देखें